Nowotwory podścieliskowe przewodu pokarmowego
 Endoskopowy obraz GIST dna żołądka (widziany w retrofleksji) |
Nowotwory podścieliskowe przewodu pokarmowego, guzy stromalne, GIST (skrótowiec od ang. gastrointestinal stromal tumors) – nowotwory tkanek miękkich wywodzące się z prekursorów komórek Cajala o charakterystycznej morfologii i typowo wykazujących ekspresję CD117[1][2][3]. Nowotwory stromalne stanowią spektrum zmian o różnej histopatologii, stopniu złośliwości i rokowaniu[4]. Reprezentują około 5% mięsaków u ludzi[4].
Choroba często przebiega bezobjawowo i jest rozpoznawana przypadkowo podczas wykonywania badań endoskopowych czy obrazowych z innego powodu niż podejrzenie choroby nowotworowej. Najczęstszym objawem choroby jest krwawienie z przewodu pokarmowego, które prezentuje się jako smoliste stolce, wymioty fusowate czy niedokrwistość z niedoboru żelaza. Nowotwór może być przyczyną bólów brzucha, nudności, wymiotów, powodować uczucie pełności i wczesnej sytości oraz utraty masy ciała[5].
Podejrzenie choroby jest stawiane na podstawie badań obrazowych lub endoskopowych[4]. Ostateczne rozpoznanie nowotworu podścieliskowego przewodu pokarmowego jest ustalane na podstawie badania histopatologicznego podczas badania mikroskopowego materiału uzyskanego podczas badania endoskopowego z wykonaniem biopsji cienkoigłowej, zwykle pod kontrolą ultrasonografii endoskopowej (EUS)[6]. W leczeniu choroby bez przerzutów podstawową metodą jest radykalna onkologicznie operacja polegająca na resekcji guza w granicach zdrowych tkanek[7]. W leczeniu choroby z przerzutami (uogólnionej), nieoperacyjnej i nawrotowej konieczne jest leczenie ogólnoustrojowe i podaje się inhibitory kinazy tyrozynowej, wśród których lekiem pierwszego rzutu jest imatynib[8].
Epidemiologia
[edytuj | edytuj kod]Guzy stromalne są najczęstszymi nowotworami mezenchymalnymi przewodu pokarmowego[9][10]. Stanowią około 5% mięsaków u ludzi[4]. Dane epidemiologiczne oceniające częstość występowania nowotworów podścieliskowych przewodu pokarmowego są bardzo zróżnicowane. Większość badań epidemiologicznych szacuje zapadalność na 10–15 przypadków na milion[9][5]. Zwykle nowotwór rozpoznaje się po 60. roku życia[11][9][12], tylko wyjątkowo występuje przed 30. rokiem życia[13], choć bywa rozpoznawany również u dzieci[11][9][12]. Bardzo małe guzy stromalne wielkości poniżej 1 cm są stosunkowo częstym zjawiskiem. Donoszono, że w badaniach sekcyjnych osób po 50. roku życia kilkumilimetrowe GIST były znajdowane u 22% badanych[11][13][14]. Sugeruje to, że większość takich zmian nie ulega progresji do istotnych klinicznie zmian[11][13]. Nowotwór występuje ze zbliżoną częstością zarówno u kobiet, jak i mężczyzn, choć u dzieci przeważającą liczbę przypadków rozpoznaje się u płci żeńskiej[11][9].
Obraz kliniczny
[edytuj | edytuj kod]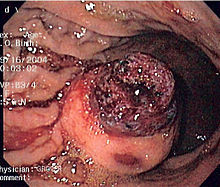
Nowotwory podścieliskowe przewodu pokarmowego najczęściej lokalizują się w żołądku (60%), jelicie czczym i krętym (30%), dwunastnicy (5%), rzadko w jelicie grubym (poniżej 5%), a jeszcze rzadziej w przełyku, wyrostku robaczkowym i pęcherzyku żółciowym[11]. W niewielkiej liczbie przypadków guzy stromalne są rozpoznawane poza przewodem pokarmowym w otrzewnej, przestrzeni zaotrzewnowej i kroczu, są one określane jako EGIST (ang. extragastrointestinal GISTs)[11]. Większość przypadków nowotworów podścieliskowych jest rozpoznawana jako choroba zlokalizowana bez przerzutów, jednakże w 10–20% przypadków GIST już w momencie rozpoznania stwierdza się obecność przerzutów odległych[15].
Obraz kliniczny jest niecharakterystyczny i prezentowane objawy zależą od lokalizacji zmian[10]. W 20% przypadków choroba jest całkowicie bezobjawowa i jest przypadkowo rozpoznawana w badaniach endoskopowych lub obrazowych, a w 10% przypadków stwierdza się ją w badaniu sekcyjnym[5]. Objawy choroby wynikają z owrzodzenia pokrywającej guz błony śluzowej albo są następstwem wielkości i masy guza[11].
Krwawienie z przewodu pokarmowego jest najczęstszym objawem choroby, który pojawia się u blisko połowy chorych[12]. Krwawienie zwykle przyjmuje charakter przewlekły i prezentuje się jako smoliste stolce, wymioty fusowate czy niedokrwistość z niedoboru żelaza. Rzadziej pojawia się krwawienie do jamy otrzewnej[5]. GIST może być przyczyną bólów brzucha, nudności, wymiotów, powodować uczucie pełności i wczesnej sytości oraz utratę masy ciała[5][12]. Guz może być powodem niedrożności przewodu pokarmowego i perforacji przewodu pokarmowego. Jednak ze względu na lokalizację podśluzówkową i tendencję do wzrostu poza światło przewodu pokarmowego niedrożność jest stosunkowo rzadkim objawem[12][16][17].
Guzy zlokalizowane w przełyku powodują zaburzenia połykania (dysfagia), ból w klatce piersiowej, ból podczas połykania, wymioty krwawe i spadek masy ciała. Guzy rosnące w żołądku powodują ból brzucha, objawy dyspeptyczne, nudności, wymioty, utratę apetytu i masy ciała[10]. W przypadku lokalizacji guza w pobliżu wpustu żołądka pojawiają się zaburzenia połykania, z kolei w pobliżu odźwiernika może dojść do jego niedrożności. W przypadku zablokowania dróg żółciowych przez guz występujący w dwunastnicy może pojawić się żółtaczka oraz zapalenie dróg żółciowych[12]. W badaniu palpacyjnym może być wyczuwalny guz w jamie brzusznej[12]. Z kolei guzy zlokalizowane w jelicie grubym są przyczyną zaburzeń wypróżnień i hematochezji[10].
Guzom stromalnym może towarzyszyć zespół paranowotworowy związany z produkcją IGF-II objawiający się hipoglikemią[10][18].
Historia naturalna
[edytuj | edytuj kod]
Nowotwory podścieliskowe przewodu pokarmowego są guzami podśluzówkowymi[12]. Guz może szerzyć się w kierunku światła przewodu pokarmowego i powodować owrzodzenie pokrywającej go błony śluzowej i krwawienie. W wyniku penetracji błony surowiczej może dojść do inwazji sąsiednich struktur anatomicznych[12]. W konsekwencji wzrostu masy i objętości guza może dochodzić do ucisku lub przemieszczenia sąsiednich struktur anatomicznych[19]. Nowotwory podścieliskowe przewodu pokarmowego szerzą się drogą krwionośną i naczyń limfatycznych[10]. Nie obserwuje się przerzutów do węzłów chłonnych[10][11]. Przerzuty typowo pojawiają się w obrębie jamy brzusznej, najczęściej w wątrobie lub jako rozsiew do jamy otrzewnej w postaci licznych drobnych zmian[11]. Wątroba stanowi lokalizację ponad połowy przerzutów, przerzuty do wątroby zwykle są liczne i o dużej średnicy. Mogą występować jako izolowana lokalizacja zmian wtórnych (20% przypadków) lub współwystępować ze zmianami śródotrzewnowymi (30% przypadków). Izolowany rozsiew do otrzewnej jest stwierdzany w 30% przypadków choroby uogólnionej[10]. Rzadko rozpoznaje się przerzuty poza jamą brzuszną w płucach, skórze, tkance podskórnej, kościach i mózgu[11]. Rzadko obserwuje się bardzo późne nawroty choroby, które mogą wystąpić nawet po 20 latach od leczenia[15][20].
Histopatologia
[edytuj | edytuj kod]
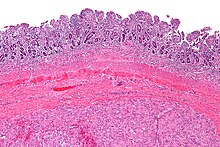

Makroskopowo nowotwór stanowi dobrze odgraniczony guz koloru białego do szarego, często otoczony pseudotorebką[5]. Mogą być widoczne obszary martwicy i krwotoków[21][5]. Typowo nowotwory podścieliskowe rosną jako pojedynczy guz, w rzadkich przypadkach nowotwór może być zmianą wieloogniskową[21]. W momencie rozpoznania wielkość guza waha się od kilku milimetrów do nawet 20 cm[21]. Nowotwór zwykle rośnie śródściennie, tworzy masę przymocowaną do ściany żołądka czy jelita, która wpuklając się do jamy brzusznej, może przemieszczać sąsiednie struktury[5]. Około 20–30% guzów stromalnych wykazuje złośliwy przebieg[12].
Mikroskopowo guz jest zlokalizowany w ścianie przewodu pokarmowego w obrębie mięśniówki właściwej (błona mięśniowa)[21]. Może szerzyć się w kierunku błony śluzowej i przekraczać blaszkę mięśniową błony śluzowej lub wzrastać w kierunku błony surowiczej (surowicówki)[22]. Utkanie może być od skąpokomórkowego do bogatokomórkowego[23], przy czym zwykle jest bogatokomórkowe[22]. Nowotwory stromalne charakteryzują się niskim pleomorfizmem i niewielką aktywnością mitotyczną, figury mitotyczne są rzadkie i dotyczą jedynie guzów o wysokiej złośliwości i odróżnicowanych[23]. Utkanie nowotworu budują komórki wrzecionowate przeważające w 70% przypadków GIST i komórki nabłonkowate (epitelioidne) przeważające w 20% przypadków GIST. W około 10% guzów stwierdza się utkanie mieszane[23].
Komórki wrzecionowate cechują się bladą cytoplazmą i wydłużonym jądrem komórkowym z ostro zakończonymi brzegami. Komórki są stosunkowo jednolite, ułożone w pęczki i arkusze, czasem tworzą struktury wirowate[23][22]. Zrąb jest ubogi[12].
Komórki nabłonkowate przyjmują kształt okrągły, o eozynofilnej lub jasnej cytoplazmie z okrągłym lub owalnym jądrem. Komórki są ułożone w struktury gniazdowate lub pasmowato[23][22][12].
Etiologia
[edytuj | edytuj kod]Pochodzenie nowotworu
[edytuj | edytuj kod]Liczne badania przemawiają za pochodzeniem nowotworu z prekursorów komórek Cajala pełniących funkcję rozrusznikową stymulującą komórki mięśniówki przewodu pokarmowego do skurczu. Mysie komórki Cajala z uzyskaną metodami inżynierii genetycznej ekspresją ludzkiego zmutowanego KIT rozwijają hiperplazję komórek Cajala ściany żołądka i jelit oraz nowotwory przypominające GIST[24][25][26]. Za wspólnym pochodzeniem przemawia ekspresja podobnych zestawów genów. Ponadto pochodzenie z prekursorów komórek Cajala pozwala wytłumaczyć ścisłą korelację pomiędzy konkretnymi mutacjami genu KIT czy PDGFRA a lokalizacją anatomiczną nowotworu[26].
Rola mutacji KIT oraz PDGFRA
[edytuj | edytuj kod]W 95% przypadków GIST w badaniu immunohistochemicznym rozpoznaje się ekspresję markera CD117 będącego receptorem kinazy tyrozynowej KIT, a w badaniach genetycznych w 70–80% guzów stwierdza się mutację genu KIT[26]. KIT w warunkach fizjologicznych jest aktywowany przez czynnik komórek macierzystych (CSF) i odpowiada za regulację proliferacji, apoptozy, chemotaksji i adhezji, stanowi krytyczny czynnik niezbędny do rozwoju i przeżycia macierzystych komórek hematopoetycznych, komórek tucznych, melanocytów i komórek Cajala[27].
Mutacje mogą obejmować region regulacyjny lub centrum kataliczne[28]. W ich wyniku dochodzi do konstytutywnej (stałej) aktywacji kinazy niezależnej od ligandu[26]. W efekcie dochodzi do aktywacji innych szlaków sygnałowych, w tym szlaku MAPK/ERK, PI3K/AKT/mTOR i JAK/STAT[26][29]. Prowadzi to do zaburzenia regulacji proliferacji, zwiększenia oporności na apoptozę oraz zaburzenia adhezji[28][29][27]. Mutacja zachodzi we wczesnym etapie inicjacji nowotworzenia GIST[28].
W około 5% przypadków nie stwierdza się ekspresji CD117 (KIT), ale wówczas najczęściej rozpoznaje się mutację PDGFRA[30]. Mutacje KIT oraz PDGFRA są mutacjami wzajemnie się wykluczającymi i stwierdza się wyłącznie jeden typ mutacji KIT albo PDGFRA zarówno w guzie pierwotnym, jak i przerzutach i zmianach nawrotowych[27][31]. PDGFR jest fizjologicznie aktywowany przez płytkopochodny czynnik wzrostu (PDGR), receptor jest obecny na komórkach prekursorowych erytropoezy, leukopoezy i trombopoezy, ale także na komórkach glejowych, komórkach śródbłonka, fibroblastach i osteoblastach[27]. PDGFR, podobnie jak KIT, jest receptorem kinazy tyrozynowej[32]. Mutacje również prowadzą do konstytutywnej aktywności kinazy tyrozynowej niezależnej od PDGF i prowadzą do aktywacji tych samych szlaków sygnałowych co mutacja KIT[26]. Z drugiej strony pomiędzy guzami z mutacją PDGFR i KIT zanotowano różnice w ekspresji niektórych genów[26][33][34].
Pozostałe mutacje kierujące
[edytuj | edytuj kod]W 10–15% GIST nie stwierdza się mutacji KIT ani PDGFRA[32][26]. Morfologicznie GIST bez mutacji KIT ani PDGFRA są nie do odróżnienia od tych z powyższymi mutacjami, ponadto w większości z nich obserwuje się wysoki poziom ekspresji KIT[26]. W części przypadków rozpoznaje się mutacje BRAF, HRAS oraz NRAS. Zarówno białka RAF i RAS stanowią element szlaku MAPK i ostatecznie dochodzi do stymulacji proliferacji niezależnie od KIT[26].
W znacznym odsetku przypadków GIST bez mutacji KIT i PDGFRA rozpoznaje się niedobór enzymu należącego do cyklu Krebsa – dehydrogenazy bursztynianowej (SDH)[35]. Większość mutacji SDH jest germinalna, choć możliwe są mutacje somatyczne genu tego enzymu[32]. Obecność mutacji SDH wyklucza mutację KIT, PDGFRA lub BRAF[32]. Niedobór dehydrogenazy bursztynianowej prowadzi do akumulacji bursztynianu i zaburzenia regulacji HIF1, który z kolei aktywuje ekspresję VEGF, IGF2 oraz ich receptorów[36]. Ostatecznie niedobór SDH powoduje powstanie pętli autokrynnej z udziałem IGF i jego receptorów[36][26]. Aktywacja receptora IGF również prowadzi do aktywacji szlaków MAPK/ERK i PI3K/AKT/mTOR, zwiększając potencjał proliferacyjny komórek i ich zdolność do przeżycia[36][26].
Mutacje związane z progresją GIST
[edytuj | edytuj kod]W ponad połowie przypadków GIST rozpoznaje się monosomię chromosomu 14 lub delecję 14q[37][38][39][26]. Prawdopodobnie kluczowa jest utrata regionu 14q11.2 obejmującego geny PARP2, APEX1 i NDRG2 oraz regionu 14q32 zawierającego gen SIVA[40][26]. Utrata długiego ramienia chromosomu 22 jest stwierdzana w blisko połowie GIST[40][26]. Często dochodzi do utraty 1p, 9p, 11p i 17p[26]. W obrębie 9p znajduje się gen CDKN2A kodujący dwa supresory p14 i p16[35]. Zyskanie dodatkowej kopii 8q (zawierający MYC), 3q (zawierający SMARCA3) i 17q wiąże się z większym prawdopodobieństwem rozwinięcia przerzutów[26].
Rozpoznanie
[edytuj | edytuj kod]Podejrzenie choroby nowotworowej jest stawiane na podstawie obrazu klinicznego, badań endoskopowych i obrazowych[4]. Małe zmiany często są wykrywane przypadkowo podczas badań z innych przyczyn niż podejrzenie choroby nowotworowej[12][41]. Z badań obrazowych największe znaczenie ma tomografia komputerowa, która umożliwia zobrazowanie zmiany oraz ocenę zaawansowania choroby[42]. W ocenie charakteru zmiany i zaawansowania pomocna jest ultrasonografia endoskopowa (EUS)[12]. Materiał do badania histopatologicznego jest uzyskiwany podczas badania endoskopowego z biopsją cienkoigłową pod kontrolą ultrasonografii endoskopowej[6]. Alternatywą jest przezskórna biopsja gruboigłowa lub biopsja otwarta podczas laparatomii[43][6]. Ostateczne rozpoznanie jest stawiane na podstawie badania histopatologicznego na podstawie oceny mikroskopowej materiału uzyskanego drogą biopsji[6]. W badaniu immunohistochemicznym stwierdza się ekspresję CD117, a w badaniach genetycznych rozpoznaje się mutację KIT lub PDGFRA[2].
Badania obrazowe i endoskopowe
[edytuj | edytuj kod]


Typowo małe zmiany są przypadkowo rozpoznawane podczas badania endoskopowego lub badań obrazowych wykonywanych z innych przyczyn niż podejrzenie choroby nowotworowej[12]. W badaniach endoskopowych, takich jak gastroskopia czy rzadziej kolonoskopia, nowotwory podścieliskowe przewodu pokarmowego są widoczne jako zmiany podśluzówkowe, owalnego kształtu w różnym stopniu wpuklające się do przewodu pokarmowego. Błona śluzowa pokrywająca guz może być prawidłowa lub też posiadać zagłębienie lub owrzodzenie[10]. Jednak z powodu tendencji do wzrostu egofitycznego poza światło przewodu pokarmowego guzy stromalne mogą nie być widoczne podczas badania endoskopowego lub tylko pośrednio ujawniać swoją obecność poprzez zewnętrzne modelowanie ściany narządu[44].
Ultrasonografia endoskopowa (EUS) jest wykorzystywana do oceny miejscowej guza, a podczas biopsji cienkoigłowej pod jej kontrolą pomaga uzyskać reprezentatywny materiał tkankowy[5]. Badanie pomaga określić wielkość guza, jego granice oraz pochodzenie z głębszej warstwy ściany przewodu pokarmowego[12]. Typowo guzy uwidaczniają się jako hipoechogenne zmiany w obrębie mięśniówki właściwej (błona mięśniowa)[45][46][10]. Większe zmiany mogą cechować się nieregularną granicą, obecnością echogennych ognisk oraz torbielowatych przestrzeni[45]. Jednak nie zawsze jest możliwe odróżnienie podczas ultrasonografii endoskopowej GIST od innych guzów mezenchymalnych[10].
Tomografia komputerowa (TK) pełni rolę w rozpoznaniu choroby, ocenie jej zaawansowania oraz planowaniu postępowania chirurgicznego[47][2][5][44]. W tomografii komputerowej GIST jest obrazowany jako dobrze odgraniczona zmiana poza światłem przewodu pokarmowego[2]. Gęstość zmian jest różna, zmiana może ulegać niejednolitemu wzmocnieniu kontrastowemu[5], co jest szczególnie zaznaczone przy większych guzach z obecną martwicą i obszarami krwotocznymi[2]. Typowo obraz jednorodnego wzmocnienia kontrastowego przemawia za łagodnym charakterem zmiany[10]. Tomografia komputerowa jest przydatna w rozpoznawaniu przerzutów odległych, szczególnie do wątroby[2]. Rezonans magnetyczny (RM) jest przydatny w ocenie zmian zlokalizowanych w miednicy oraz oceny rozsiewu do otrzewnej[2].
W USG nowotwory podścieliskowe przewodu pokarmowego są obrazowane jako hipoechogenne zmiany, które przy odpowiedniej wielkości mogą uciskać sąsiednie struktury anatomiczne[2]. Obecność zmiany w obrębie ściany przewodu pokarmowego znacząco utrudnia jej zobrazowanie, ponadto często występuje znaczna trudność w określeniu lokalizacji zmiany[44].
Pozytonowa tomografia emisyjna (PET) jest przydatna w rozpoznawaniu niewielkich przerzutów oraz pomaga zróżnicować aktywny metabolicznie guz od blizny lub innych zmian łagodnych[5][7].
Biopsja
[edytuj | edytuj kod]Konwencjonalna biopsja za pomocą kleszczyków wykonywana podczas badania endoskopowego ma ograniczone zastosowanie w związku z głębszą lokalizacją guza pod błoną śluzową i ograniczonym zasięgiem kleszczyków oraz zwiększonym ryzykiem perforacji podczas wykonywania biopsji[12][10].
Biopsja cienkoigłowa pod kontrolą endoskopowej ultrasonografii jest metodą z wyboru w uzyskiwaniu materiału tkankowego do badania histopatologicznego[2][5]. Technika biopsji cienkoigłowej pod kontrolą EUS nie zawsze umożliwia dostarczenie odpowiedniej ilości materiału tkankowego i nie zawsze umożliwia ostateczne rozpoznanie histopatologiczne, a szczególnie różnicowanie pomiędzy zmianami prawdopodobnie łagodnymi a złośliwymi[2][10]. Czułość metody jest oceniana na 78%[48].
Biopsja podczas badania endoskopowego jest korzystniejsza od biopsji przezskórnej, która wiąże się z większym ryzykiem istotnego krwawienia oraz ryzykiem rozsiewu nowotworu[6]. Przezskórna biopsja może być przydatna w celu potwierdzenia obecności przerzutów choroby[6].
Nie ma konieczności uzyskania rozpoznania cytologicznego czy histopatologicznego przed leczeniem chirurgicznym choroby operacyjnej[2]. Jednak uzyskanie rozpoznania histopatologicznego jest konieczne przed rozpoczęciem leczenia choroby lokalnie zaawansowanej lub z przerzutami[2][6].
Badanie histopatologiczne
[edytuj | edytuj kod]Rozpoznanie nowotworu podścieliskowego przewodu pokarmowego jest stawiane na podstawie badania histopatologicznego podczas badania mikroskopowego[6][12]. Standardowo wykorzystuje się techniki immunohistochemii, która pozwala potwierdzić rozpoznanie GIST oraz wykluczyć rozpoznania innych nowotworów o podobnej morfologii[10]. Typowo w immunohistochemii stwierdza się ekspresję CD117, a w badaniach genetycznych stwierdza się mutację KIT lub PDGFRA[2]. Badanie histopatologiczne umożliwia ustalenie czynników ryzyka nawrotu GIST[22]. Raport histopatologiczny zawiera opis lokalizacji guza, jego wielkość, ocenę reakcji dla CD117 i CD34 (ewentualnie także DOG-1, SMA, desmina, S-100, Caldesmon H), liczbę figur mitotycznych, ocenę zaawansowania według klasyfikacji TNM oraz ocenę ryzyka nawrotu (stopnia agresywności) według konsensusu AFIP-NCCN-AJCC[22].
- Immunohistochemia

Diagnostyka immunohistochemiczna jest przydatna w różnicowaniu GIST z nerwiakiem osłonkowym, nowotworami tkanki mięśniowej gładkiej i rakami sarkomatoidalnymi[49]. Rutynowo w diagnostyce różnicowej wykorzystuje się panel dla KIT (CD117), DOG1, S-100 i desminy[31]. Potwierdzenie reakcji dla CD117 ma znaczenie diagnostyczne, ponieważ pozwala odróżnić inne nowotwory przypominające nowotwory podścieliskowe przewodu pokarmowego, w tym nerwiak osłonkowy i mięśniak gładkokomórkowy, a także znaczenie kliniczne przy kwalifikacji do leczenia inhibitorami kinaz tyrozynowych[30].
W 95% przypadków GIST stwierdza się rozlaną reakcję dla CD117 (KIT)[50][51][30]. W około 5% przypadków nie stwierdza się ekspresji CD117 (KIT), a wówczas zwykle stwierdza się mutację PDGFRA[30].
DOG1 jest wysoce swoistym i czułym markerem GIST[52][53][54][55]. Często dodatnia reakcja dla DOG1 jest stwierdzana w guzach KIT-negatywnych, co znajduje zastosowanie w diagnostyce immunohistochemicznej tych guzów[56]. Reakcja CD34 jest pozytywna dla około 70% GIST, jednak marker nie jest już stosowany w diagnostyce różnicowej[56]. W GIST okazjonalnie rozpoznaje się dodatnią reakcję dla S-100 (5%), desminy (2%) i cytokeratyn (2%)[49].
- Diagnostyka genetyczna i molekularna
Diagnostyka genetyczna z oznaczaniem obecności mutacji KIT i PDGFRA jest wykorzystywana w diagnostyce GIST[6]. W 95% przypadków nowotwory podścieliskowe przewodu pokarmowego wykazują ekspresję CD117 (KIT). W około 80% stwierdza się mutację aktywującą genu KIT kodującego receptor kinazy tyrozynowej, którego stała aktywność jest krytycznym i niezbędnym elementem karcynogenezy tego guza[6][32]. W blisko 70% mutacja jest stwierdzana w eksonie 11, w 10% w eksonie 9 i około 1% w eksonie 13 i 17[32]. W 5–10% przypadków tych guzów stwierdza się mutację genu PDGFRA kodującego receptor kinazy tyrozynowej[6]. W badaniu immunohistochemicznym przypadki mutacji genu PDGFRA wykazują ujemną lub słabą reakcję dla KIT[32]. Mutacje KIT i PDGFRA są mutacjami wzajemnie wykluczającymi[32]. Z kolei w 10–15% GIST nie stwierdza się mutacji KIT ani PDGFRA (wild-type GIST, WT-GIST)[6][32]. Brak mutacji KIT czy PDGFRA nie wyklucza rozpoznania GIST[5]. W wielu przypadkach GIST bez mutacji KIT ani PDGFRA stwierdza się mutację genu SDH[6]. W około 3% GIST stwierdza się mutację BRAF, podobnie jak w czerniaku czy raku rdzeniastym tarczycy w kodonie V600E[32]. W badaniu immunohistochemicznym przypadki mutacji BRAF również dają pozytywną reakcję dla KIT[32].
Ocena ryzyka nawrotu
[edytuj | edytuj kod]Około 20–30% guzów stromalnych wykazuje złośliwy przebieg[12]. Z drugiej strony na podstawie badania histopatologicznego trudno przewidzieć kliniczny przebieg tego nowotworu[41]. Najpewniejszym wskaźnikiem wskazujący na złośliwy charakter GIST jest obecność przerzutów odległych[41]. Kluczowymi czynnikami przemawiającymi za złośliwością guza jest lokalizacja zmiany, wielkość i indeks mitotyczny[57]. Istotne rokowniczo jest pęknięcie torebki guza podczas zabiegu operacyjnego[57].
Na podstawie powyższych czynników ryzyka powstało kilka klasyfikacji prognostycznych, z których największe znaczenie ma NIH, AFIP i Joensuu. W klasyfikacji AFIP lokalizacja zmiany jest klasyfikowana według umiejscowienia zmiany w żołądku, dwunastnicy, jelicie czczym/krętym oraz odbytnicy. Zmiany położone poza wymienionymi lokalizacjami są klasyfikowane jak zmiany w jelicie czczym i krętym. Wielkość zmiany podzielono pomiędzy kategoriami poniżej 2 cm, 2–5 cm, 5–10 cm i powyżej 10 cm. Wartość indeksu mitotycznego podzielono na dwie kategorie: poniżej i powyżej 5 mitoz w 50 polach widzenia[57]. Określenie ryzyka nawrotu ma duże znaczenie kliniczne, ponieważ jest używane w kwalifikacji do leczenia uzupełniającego po radykalnym zabiegu uzupełniającym[57].
Wielkość zmiany powyżej 10 cm z wysokim indeksem mitotycznym powyżej 5 w 50 HPF przemawia raczej za charakterem złośliwym. Z kolei zmiany poniżej 2 cm z niskim indeksem mitotycznym poniżej 5 w 50 HPF raczej będą przyjmować łagodny przebieg (nie stosuje się pojęcia łagodny GIST[58])[41].
| Cechy nowotworu | Ryzyko nawrotu | ||||
| Indeks mitotyczny | Wielkość guza | Żołądek | Dwunastnica | Jelito czcze i kręte | Odbytnica |
| ≤50 w 50 HPF | ≤2 cm | brak (0%) | brak (0%) | brak (0%) | brak (0%) |
| >2 cm–≤5 cm | bardzo niskie (1,9%) | niskie (8,3%) | niskie (4,3%) | niskie (8,5%) | |
| >5 cm–≤10 cm | niskie (3,6%) | brak danych | pośrednie (24%) | brak danych | |
| >10 cm | wysokie (10%) | wysokie (34%) | wysokie (52%) | wysokie (57%) | |
| >50 w 50 HPF | ≤2 cm | brak (0%) | brak danych | wysokie | pośrednie (24%) |
| >2 cm–≤5 cm | pośrednie (16%) | wysokie (50%) | wysokie (73%) | wysokie (52%) | |
| >5 cm–≤10 cm | wysokie (55%) | brak danych | wysokie (85%) | brak danych | |
| >10 cm | wysokie (86%) | wysokie (86%) | wysokie (90%) | wysokie (71%) | |
Zaawansowanie kliniczne
[edytuj | edytuj kod]| Guz pierwotny – cecha T | |
| Tx | nie można ocenić guza pierwotnego |
| T0 | nie stwierdza się guza pierwotnego |
| T1 | guz mniejszy lub równy 2 cm |
| T2 | guz większy niż 2 cm i mniejszy niż 5 cm |
| T3 | guz większy niż 5 cm i mniejszy niż 10 cm |
| T4 | guz większy niż 10 cm |
| Zajęcie okolicznych węzłów chłonnych – cecha N | |
| N0 | nie stwierdza się przerzutów w okolicznych węzłach chłonnych |
| N1 | przerzuty obecne w węzłach chłonnych |
| Przerzuty odległe – cecha M | |
| M0 | nie stwierdza się przerzutów odległych |
| M1 | obecne przerzuty odległe |
| Stopień zaawansowania | Cecha T | Cecha N | Cecha M | Indeks mitotyczny |
| IA | T1 | N0 | M0 | Niski |
| T2 | N0 | M0 | Niski | |
| IB | T3 | N0 | M0 | Niski |
| II | T1 | N0 | M0 | Wysoki |
| T2 | N0 | M0 | Wysoki | |
| T4 | N0 | M0 | Niski | |
| IIIA | T3 | N0 | M0 | Wysoki |
| IIIB | T4 | N0 | M0 | Wysoki |
| IV | każde T | N1 | M0 | każdy |
| każde T | każde N | M1 | każdy |
| Stopień zaawansowania | Cecha T | Cecha N | Cecha M | Indeks mitotyczny |
| I | T1 | N0 | M0 | Niski |
| T2 | N0 | M0 | Niski | |
| II | T3 | N0 | M0 | Niski |
| IIIA | T1 | N0 | M0 | Wysoki |
| T4 | N0 | M0 | Niski | |
| IIIB | T2 | N0 | M0 | Wysoki |
| T3 | N0 | M0 | Wysoki | |
| T4 | N0 | M0 | Wysoki | |
| IV | każde T | N1 | M0 | każdy |
| każde T | każde N | M1 | każdy |
Leczenie
[edytuj | edytuj kod]W leczeniu choroby bez przerzutów podstawową metodą jest postępowanie chirurgiczne polegające na resekcji guza w granicach zdrowych tkanek[7]. Zwykle wykonuje się zabiegi zachowujące narząd, unikając rozległych, okaleczających operacji[7]. U chorych o wysokim ryzyku nawrotu po radykalnej operacji stosuje się leczenie uzupełniające[63], a część chorych wymaga leczenia przedoperacyjnego, które pomaga zmniejszyć masę guza i konieczny zakres operacji[64]. U około połowy chorych pomimo leczenia operacyjnego obserwuje się nawroty w postaci rozsiewu do wątroby czy jamy otrzewnej[5]. W leczeniu ogólnoustrojowym podaje się inhibitory kinazy tyrozynowej, wśród których lekiem pierwszego rzutu jest imatynib. Lek wykorzystuje się zarówno w leczeniu adiuwantowym i neoadiuwantowym, jak i w chorobie zaawansowanej z przerzutami, chorobie nieoperacyjnej oraz nawrotach choroby. U większości leczonych imatynib prowadzi do obiektywnych odpowiedzi i długotrwałych korzyści klinicznych[8]. U 10–15% chorych obserwuje się pierwotną oporność na imatynib lub jego nietolerancję[65]. Około połowa chorych w ciągu 2 lat stosowania imatynibu doświadcza wtórnej oporności na lek i progresji[66]. W leczeniu choroby progresywnej zwiększa się dawkę imatynibu do maksymalnej, a następnie w drugiej linii leczenia stosuje się sunitynib[66].
Leczenie choroby bez przerzutów
[edytuj | edytuj kod]Leczenie chirurgiczne
[edytuj | edytuj kod]Leczenie chirurgiczne jest podstawową metodą terapii u chorych z potencjalnie operacyjnym (resekcyjnym) nowotworem podścieliskowym przewodu pokarmowego bez przerzutów[7][5][67]. Jest to jedyna metoda leczenia umożliwiająca całkowite wyleczenie[65][4][41]. Celem zabiegu jest całkowita resekcja zmiany w zakresie marginesu zdrowych tkanek (resekcja R0)[7]. Wystarczającym postępowaniem jest operacja zachowująca narząd z wykonaniem segmentarnej czy klinowej resekcji z marginesem chirurgicznym wolnym od nacieku nowotworowego[4][7][5]. Unika się rozległych, okaleczających, wielonarządowych zabiegów, ponieważ zabieg ma wywoływać możliwie jak najmniejszą chorobowość[5][7][68]. Szerokie marginesy resekcji nie wpływają na poprawę rokowania leczonych, ponieważ guzy stromalne nie wykazują tendencji do rozległego nacieku wzdłuż ściany narządu[41]. Jednak w niektórych przypadkach konieczne jest usunięcie w jednym bloku tkankowym (en block) sąsiadujących struktur anatomicznych[2][69][41]. W przypadku zabiegów granicznie operacyjnych zabieg poprzedza leczenie neoadiuwantowe imatynibem[8][68]. W zmianach zlokalizowanych w zakresie żołądka wykonuje się resekcję klinową guza z fragmentem ściany narządu, rzadziej wykonuje się gastrektomię subtotalną lub totalną. W zmianach w jelicie cienkim lub grubym wykonuje się resekcję odcinkową[70][71]. Istotne jest nienaruszenie pseudotorebki guza i unikanie pęknięcia guza, który jest dość kruchy[7][65][69][70]. GIST rzadko daje przerzuty do węzłów chłonnych, dlatego limfadenektomia nie jest w większości przypadków koniecznym elementem zabiegu, jednak u niektórych chorych z GIST związanym z niedoborem SDH wykonuje się limfadenektomię[2][7].
Ocenia się, że całkowita resekcja jest możliwa w 85% przypadków nowotworów podścieliskowych przewodu pokarmowego[72][5][41]. W przypadku nie uzyskania marginesów mikroskopowo wolnych od nacieku nowotworowego (resekcja R1) dalsze postępowanie jest indywidualizowane. Choć resekcja z mikroskopowym naciekiem nowotworowym wiąże się z większym ryzykiem miejscowego nawrotu, to najprawdopodobniej nie wiąże się z gorszym przeżyciem całkowitym[73][74][75][2][69]. Opcjami leczniczymi u chorych z mikroskopowym naciekiem nowotworowym jest ponowna operacja, obserwacja chorego oraz leczenie imatynibem[65][2]. Generalnie u chorych z mikroskopowym naciekiem nowotworu podścieliskowego nie ma konieczności wykonywania reoperacji[7][5]. Reoperacja nie powinna nieść ze sobą poważnego wpływu na czynność przewodu pokarmowego[70], a warunkiem przeprowadzenia ponownej operacji jest dokładne ustalenie lokalizacji guza[70][58][2].
U wybranych chorych z niewielkimi zmianami o korzystnej lokalizacji mogą być wykorzystane techniki laparoskopowe[8]. W metaanalizie nie wykazano różnicy w osiąganych wynikach długoterminowych pomiędzy operowanymi laparoskopowo, a operowanymi metodą otwartą[76][8]. W przypadku dużych zmian większych niż 5 cm laparoskopia nie jest zalecana i preferuje się laparotomię[65].
W przypadku bardzo małych zmian poniżej 2 cm rola leczenia chirurgicznego jest niejasna, ponieważ nie jest znana historia naturalna takich zmian, w tym tempo ich wzrostu i ich zdolność do tworzenia przerzutów[13]. Zwykle operacji poddaje się jedynie zmiany wywołujące objawy, a zmiany bezobjawowe, o ile nie wykazują ultrasonograficznych cech wysokiego ryzyka, poddaje się obserwacji w badaniach endoskopowych[64].
Przedoperacyjne leczenie imatynibem
[edytuj | edytuj kod]
W leczeniu neoadiuwantowym (przedoperacyjnym) nowotworów podścieliskowych przewodu pokarmowego stosuje się imatynib, który jest selektywnym inhibitorem receptora kinazy tyrozynowej[8]. Lek może pozwolić zmniejszyć wielkość nowotworu przed resekcją, potencjalnie zmniejszając zakres koniecznej resekcji[5]. Imatynib wykorzystuje się w leczeniu przedoperacyjnym w celu obniżenia stopnia zaawansowania nowotworu i umożliwienia wykonania operacji z uzyskaniem wolnych marginesów chirurgicznych potencjalnie operacyjnych nowotworów podścieliskowych przewodu pokarmowego, u których nie ma możliwości wykonania zabiegu operacyjnego bez nieakceptowalnego deficytu funkcjonalnego oraz chorobowości[64][77]. Imatynib jest podawany w dawce dziennej 400 mg, choć przy udokumentowanej mutacji KIT w eksonie 9 dawka może być zwiększana do 800 mg. Nie określono optymalnej długości leczenia przedoperacyjnego i leczenie jest kontynuowane do czasu uzyskania maksymalnej odpowiedzi na lek określanej jako brak dalszej poprawy w porównaniu do poprzedniego badania obrazowego. Zabieg operacyjny może być wykonany przed osiągnięciem maksymalnej odpowiedzi, gdy leczenie osiągnęło wcześniej założone cele[64]. Z drugiej strony wydłużenie leczenia neoadiuwantowego powyżej 12 miesięcy może wiązać się z większym ryzykiem powstania oporności na lek, dlatego unika się wydłużania leczenia neoadiuwantowego powyżej 12 miesięcy[78][79]. W przypadku pojawienia się progresji podczas leczenia imatynibem leczenie przerywa się i ponownie ocenia się wskazania do zabiegu operacyjnego[65].
W kilku niewielkich badaniach prospektywnych wykazano bezpieczeństwo i skuteczność leczenia neoadiuwantowego za pomocą imatynibu[80][78][15]. W badaniu Fiore i współpracowników imatynib korzystnie wpływał na poprawę resekcyjności zmian i zmniejszenie chorobowości zabiegu. Zaobserwowano medianę zmniejszenia się wymiaru guza o 34%[81]. W badaniu na 19 chorych odsetek odpowiedzi wynosił 69%[82]. W badaniu BFR14 60% chorych leczonych neoadiuwantowo osiągnęło częściową remisję (PR)[83]. Badania nie pozwalają na ocenę rzeczywistego wpływu na przeżycie całkowite, ponieważ chorzy dalej otrzymywali imatynib w leczeniu uzupełniającym[80]. Lek nie zwiększa ryzyka powikłań pooperacyjnych[65].
Pooperacyjne leczenie imatynibem
[edytuj | edytuj kod]U około połowy leczonych z powodu nowotworu podścieliskowego przewodu pokarmowego samodzielne leczenie chirurgiczne jest wystarczające do wyleczenia choroby[15]. Z drugiej strony połowa leczonych doświadcza nawrotu w postaci wznowy miejscowej lub przerzutów odległych[63][84][17][72]. Zatem część chorych wymaga leczenia uzupełniającego (adiuwantowe, pooperacyjne), ale część nie odnosi z niego korzyści[15][72]. Kluczową w identyfikacji chorych wymagających dalszego leczenia uzupełniającego po operacji i odnoszących korzyści z tego leczenia jest identyfikacja czynników ryzyka nawrotu choroby[72].
Kwalifikacja do leczenia uzupełniającego opiera się o ocenę ryzyka nawrotu uwzględniającą liczbę mitoz powyżej 5/50, wielkość guza powyżej 5 cm, lokalizację pozażołądkową i pęknięcie jego torebki[63][5]. W kwalifikacji do leczenia adiuwantowego wykorzystuje się klasyfikację AFIP lub starszą klasyfikację NIH[15]. U chorych o wysokim ryzyku nawrotu po radykalnej operacji stosuje się leczenie uzupełniające[63]. W leczeniu adiuwantowym wykorzystuje się imatynib, który podaje się przez 36 miesięcy[85][15]. U chorych otrzymujących leczenie neoadiuwantowe po zabiegu operacyjnym kontynuuje się leczenie imatynibem jako terapię adiuwantową[85].
Skuteczność leczenia pooperacyjnego imatynibem wykazano w kilku badaniach klinicznych. W badaniu III fazy ACOSOG Z9001 porównano skuteczność imatynibu w leczeniu uzupełniającym po zabiegu operacyjnym do samodzielnego zabiegu i obserwacji chorych. Wykazano, że chorzy otrzymujący imatynib osiągali dłuższą medianę przeżycia wolnego od nawrotu (RFS), przy czym w tym badaniu osiągana mediana przeżycia całkowitego (OS) nie różniła się znacząco pomiędzy obiema grupami[86][87][63]. W skandynawskim badaniu wykazano, że podawanie imatynibu przez 36 miesięcy jest skuteczniejsze w wydłużaniu mediany przeżycia całkowitego (OS) i przeżycia wolnego od nawrotu (RFS) niż podaż przez 12 miesięcy[88].
Leczenie choroby z przerzutami, nieoperacyjnej i nawrotowej
[edytuj | edytuj kod]

W leczeniu choroby z przerzutami, choroby nieoperacyjnej oraz choroby nawrotowej stosuje się leczenie celowane oparte na inhibitorach kinazy tyrozynowej[85][89][2]. Lekiem pierwszego rzutu jest imatynib obejmujący w swoim spektrum KIT i PDGFR[8][2]. Lek standardowo podaje się w dawce 400 mg, a u chorych z mutacją KIT w eksonie 9 opcją jest zwiększenie dawki 800 mg[2][65].
U większości chorych imatynib prowadzi do obiektywnych odpowiedzi i długotrwałych korzyści klinicznych[8]. Dwie trzecie chorych leczonych tym lekiem osiąga odpowiedź obiektywną, mediana czasu przeżycia wolnego od progresji przekracza dwa lata, a 15% chorych osiąga długotrwałą odpowiedź na leczenie trwającą ponad 10 lat[65]. U 10–15% chorych obserwuje się pierwotną oporność na imatynib lub jego nietolerancję[65]. W badaniu klinicznym II fazy Demetri i współpracowników imatynib powodował uzyskanie częściowej odpowiedzi (PR) u 68,1% i stabilizację choroby u 15,6% (SD). Mediana przeżycia wolnego od progresji wynosiła 24 miesiące, a mediana przeżycia całkowitego 57 miesięcy[90][91][78]. W dziewięcioletniej obserwacji 35% leczonych imatynibem osiągnęło dziewięcioletnie przeżycie całkowite[92][8].
Kolejne badania miały na celu ustalenie optymalnej dawki imatynibu[78]. W dwóch badaniach klinicznych III fazy EORTC 62005 i S0033/CALGB 150105 porównujących skuteczność dawki imatynibu 400 mg i 800 mg nie wykazano różnicy w odsetku odpowiedzi oraz osiąganym przeżyciu całkowitym pomiędzy niższą, a wyższą dawką leku, choć w badaniu EORTC 62005 opisano nieznaczne wydłużenie czasu przeżycia wolnego od progresji (PFS), czego z kolei nie stwierdzono w badaniu S0033/CALGB 150105. Jednocześnie wyższa dawka wiązała się z wyższym ryzykiem działań niepożądanych[93][94][95][96]. Przy progresji przy leczeniu imatynibem w dawce 400 mg podano lek w wyższej dawce 800 mg, osiągając stabilizację choroby (SD)[94][95][80]. W metaanalizie tych dwóch badań na łącznej liczbie 1640 chorych również nie potwierdzono poprawy przeżycia całkowitego u chorych leczonych wyższą dawką imatynibu, choć wiązała się ona z dłuższym czasem przeżycia wolnego od progresji (PFS). Wydłużenie przeżycia wolnego od progresji dotyczyło wyłącznie chorych z mutacją KIT w eksonie 9[97][78]. W innym badaniu wykazano istotne korzyści w osiąganym czasie przeżycia wolnego od progresji u chorych z mutacją KIT w eksonie 9 ze zwiększania dawki imatynibu do 800 mg[98][2].
Odsetek odpowiedzi na imatynib różni się w zależności od lokalizacji mutacji genu KIT[2][99][98][100]. Ocenia się, że imatynib wywołuje obiektywne odpowiedzi u 72% chorych z mutacją w eksonie 11, u 38% z mutacją w eksonie 9 i u 28% chorych z WT-GIST[2]. Z kolei najczęstsza mutacja PDGFRA D842 V wiąże się z całkowitą opornością na imatynib[2][101].
Oporność na imatynib
[edytuj | edytuj kod]Około 10–15% chorych pomimo leczenia imatynibem wykazuje pierwotną, wczesną oporność w ciągu 6 miesięcy od włączenia leku, a oporność wtórna pojawiająca się w ciągu 2–3 lat leczenia imatynibem dotyczy około 40–50% chorych[66]. Głównymi mechanizmami pierwotnej oporności na imatynib są mutacja PDGFRA 842V, mutacja KIT w eksonie 9 oraz wild-type GIST (WT-GIST). Z kolei wtórna oporność na imatynib jest spowodowana wytworzeniem nowych mutacji prowadzących do konstytutywnej aktywacji kinazy tyrozynowej w miejscu wiązania ATP lub pętli aktywacyjnej[65]. Możliwa jest utrata ekspresji KIT w połączeniu z aktywacją alternatywnych kinaz tyrozynowych lub innych onkogenów[5]. Oporność może być zjawiskiem zlokalizowanym objawiającym się wzrostem (progresją) jednej zmiany przy stabilnym obrazie pozostałych zmian lub jako zjawisko uogólnione z progresją licznych zmian[59].
W przypadku progresji choroby przy standardowych dawkach imatynibu opcjami terapeutycznymi są eskalacja dawki imatynibu lub zmiana leczenia na inhibitor kinazy tyrozynowej drugiej linii (sunitynib)[66][8][102].
W modyfikacji leczenia w pierwszej kolejności zwiększa się dawkę imatynibu z 400 mg do 800 mg, co pomaga przełamać oporność na lek[5]. Zwiększenie dawki leku może spowodować wydłużenie czasu wolnego od progresji choroby[65][5][97][94]. U chorych z ograniczoną progresją, gdy większość ognisk choroby jest dalej kontrolowana przez imatynib, raczej kontynuuje się leczenie imatynibem w tej samej dawce lub dawce maksymalnej bez zmiany imatynibu na inhibitory kinazy tyrozynowej drugiego rzutu[13].
Sunitynib jest inhibitorem wielu kinaz tyrozynowych, w tym KIT i PDGFRA[78]. Znajduje zastosowanie w leczeniu drugiej linii po progresji choroby u chorych leczonych imatynibem[103]. Lek podaje się w dawce dziennej 50 mg przez 4 tygodnie w cyklu co 2 tygodnie lub schemacie z codzienną dawką 37,5 mg bez stosowania przerw[2]. W badaniu III fazy u chorych z progresją podczas leczenia imatynibem porównano skuteczność sunitynibu w dawce dziennej 50 mg z placebo. Wykazano, że sunitynib wpływa na wydłużenie czasu do progresji choroby (TTP) z 1,5 miesiąca do 6,3 miesięcy[104][2]. W badaniu na 1124 chorych z progresją podczas leczenia imatynibem podawanego w schemacie 50 mg mediana przeżycia wolnego od progresji (PFS) wynosiła 8,3 miesięcy, a mediana przeżycia całkowitego 16,6 miesięcy[105][103]. W kolejnym badaniu III fazy oceniano skuteczność sunitynibu w dawce 37,5 mg w porównaniu z placebo, lek wywoływał częściową remisję (PR) u 13% leczonych i stabilizację choroby (SD) u 40%[106][103]. Prawdopodobnie schemat dawkowania bez przerw wiąże się z lepszą tolerancją[103]. Lek wykazuje większą skuteczność w GIST-WT oraz mutacji KIT w eksonie 9 i 11[107][2].
U chorych z progresją podczas leczenia imatynibem i sunitynibem podaje się regorafenib, który jest inhibitorem wielu kinaz tyrozynowych w tym KIT i PDGFRA[108]. W badaniu klinicznym porównującym regorafenib z placebo lek wydłużał medianę przeżycia wolnego od progresji (PFS) do 1,8 miesiąca, podczas gdy chorzy otrzymujący placebo osiągali medianę przeżycia wolnego od progresji 0,9 miesiąca[109][110][65]. Kolejne linie leczenia po progresji podczas leczenia imatynibem, sunitynibem i regorafenibem obejmują nilotynib[111], sorafenib[112][113] i imatynib w niskiej dawce z doksorubicyną[114].
W przypadku uogólnionej progresji i całkowitego odstawienia inhibitorów kinazy tyrozynowej może dojść do szybkiej progresji klonów dotychczas wrażliwych na inhibitory kinazy tyrozynowej i kontrolowanych przez te leki[13]. Zatem inhibitory kinazy tyrozynowej stanowią istotny składnik leczenia wspomagającego u chorych z chorobą progresywną[13]. U chorych z progresją nie odnoszących korzyści z dotychczasowego leczenia inhibitorami kinazy tyrozynowej opcją leczniczą może być ponowne wprowadzenie uprzednio stosowanego i dobrze tolerowanego leku[108].
Leczenie chirurgiczne w chorobie zaawansowanej
[edytuj | edytuj kod]Leczenie choroby nieoperacyjnej jest oparte o inhibitory kinaz tyrozynowych[85]. Lek może spowodować zmniejszenie masy guza i umożliwić wykonanie zabiegu operacyjnego bez powodowania istotnego deficytu funkcjonalnego[2].
Leczenie chirurgiczne choroby z przerzutami ma dość ograniczone zastosowanie[115]. U starannie wybranych chorych z przerzutami w wątrobie wykonuje się ich resekcję (metastazektomia), a następnie kontynuuje się leczenie inhibitorami kinazy tyrozynowej[85]. Nie jest jasne czy takie postępowanie faktycznie prowadzi do poprawy przeżycia całkowitego leczonych taką metodą[85][115]. Warunkiem przeprowadzenia zabiegu jest korzystna lokalizacja zmian i możliwość ich całkowitego wycięcia u chorego odpowiadającego na leczenie inhibitorami kinaz tyrozynowych[85].
W korzystnie zlokalizowanych zmianach z ograniczoną ogniskową progresją (progresja 1–2 zmian przy stabilizacji obrazu pozostałych zmian) u wybranych chorych wykorzystuje się postępowanie zabiegowe obejmujące resekcję, termoablację lub chemioembolizację[116][108][117][118][119][5]. Resekcja takich ognisk może pozwolić na eliminację klonów opornych na imatynib, co może umożliwić kontynuację leczenia tym lekiem[5]. Z drugiej strony niepełne resekcje wiążą się ze znacznym odsetkiem powikłań[108].
Leczenie chirurgiczne również znajduje zastosowanie w leczeniu paliatywnym niedrożności, perforacji jelita lub krwawienia[115].
Klasyczna chemioterapia
[edytuj | edytuj kod]Nowotwory podścieliskowe przewodu pokarmowego wykazują znaczną oporność na klasyczne cytostatyki[8][2]. Interpretacja starszych badań jest trudna, ponieważ część GIST dawniej było klasyfikowane jako mięśniakomięsak gładkokomórkowy. Doksorubicyna i ifosfamid, które są podstawowymi cytostatykami w leczeniu mięsaków tkanek miękkich, wykazują niewielką aktywność w leczeniu GIST[19]. Odsetki odpowiedzi na cytostatyki nie przekraczają 10%[120][19].
Ocena odpowiedzi na leczenie
[edytuj | edytuj kod]Odpowiedź na leczenie jest oceniana w badaniach obrazowych, głównie tomografii komputerowej, w oparciu o kryteria RECIST[2], jednak pewną przewagę mają kryteria Choi[121][7], które poza wielkością zmian oceniają również jej gęstość, co pozwala wykluczyć rzekomą progresję zmiany związaną wyłącznie ze zwiększeniem jej objętości z jednoczesnym spadkiem jej gęstości[2]. Z drugiej strony kryteria Choi nie są tak szeroko akceptowane jak RECIST[7].
Rokowanie
[edytuj | edytuj kod]Odsetek przeżyć pięcioletnich w zależności od wielkości zmiany, lokalizacji oraz indeksu mitotycznego wynosi 35–65%[12]. W analizie SEER odsetek trzyletniego przeżycia specyficznego dla nowotworu (CSS) w chorobie bez przerzutów wynosi 92,2%. Z kolei w chorobie z przerzutami odsetek przeżyć trzyletnich specyficznych dla nowotworu wynosi 61,9%[122].
Historia
[edytuj | edytuj kod]Nowotwory podścieliskowe przewodu pokarmowego wcześniej były klasyfikowane jako mięśniaki gładkokomórkowe i mięśniakomięsaki gładkokomórkowe. W latach 70. i 80. XX wieku dzięki wprowadzeniu mikroskopu elektronowego i metod immunohistochemicznych zauważono, że istnieje grupa nowotworów bez wyrażania cech nowotworów tkanki mięśniowej gładkiej[4]. W 1983 roku Mazur i Clark wyodrębnili grupę nowotworów nazwaną nowotwory podścieliskowe przewodu pokarmowego[123][4]. W połowie lat 90. postawiono tezę o pochodzeniu tego nowotworu z komórek Cajala[124][4]. W 1998 roku opisano nadekspresję KIT (CD117)[125][4]. Na początku lat dwutysięcznych do leczenia GIST wprowadzono imatynib[126].
Weterynaria
[edytuj | edytuj kod]Guzy stromalne zostały zidentyfikowane u psów, koni i naczelnych[127]. Podobnie jak u człowieka utkanie guza w obrębie mięśniówki właściwej tworzą komórki wrzecionowate i nabłonkowate wykazujące ekspresję CD117 i CD34[127]. Guz może być zlokalizowany w żołądku, jelicie cienkim i grubym[128]. Do objawów choroby należą utrata apetytu, utrata masy ciała, wymioty, krwawienie do przewodu pokarmowego oraz niedrożność jelit[129].
Zdjęcie rentgenowskie i USG może wykazać obecność guza w jamie brzusznej[128]. Czasami wykorzystuje się techniki endoskopowe[129]. W celu ostatecznego rozpoznania konieczne jest uzyskanie materiału do badania histopatologicznego, który zwykle uzyskuje się podczas laparotomii zwiadowczej[129]. Techniki immunohistochemiczne mogą być przydatne do różnicowania GIST z mięśniakomięsakiem gładkokomórkowym[130].
Podstawową metodą leczenia jest zabieg operacyjny polegający na wycięciu guza w zakresie zdrowych tkanek. W związku z obecnością mutacji KIT opisywano próby leczenia za pomocą imatynibu, choć jego skuteczność nie jest oceniona[129][131][132].
Klasyfikacja ICD10
[edytuj | edytuj kod]| kod ICD10 | nazwa choroby |
|---|---|
| ICD-10: C15 | Nowotwór złośliwy przełyku |
| ICD-10: C16 | Nowotwór złośliwy żołądka |
| ICD-10: C17 | Nowotwór złośliwy jelita cienkiego |
| ICD-10: C18 | Nowotwór złośliwy jelita grubego |
| ICD-10: C19 | Nowotwór złośliwy zgięcia esiczo-odbytniczego |
| ICD-10: C20 | Nowotwór złośliwy odbytnicy |
| ICD-10: C49 | Nowotwór złośliwy tkanki łącznej i innych tkanek miękkich |
Przypisy
[edytuj | edytuj kod]- ↑ M. Miettinen, J. Lasota. Gastrointestinal stromal tumors (GISTs): definition, occurrence, pathology, differential diagnosis and molecular genetics. „Pol J Pathol”. 54 (1), s. 3–24, 2003. PMID: 12817876.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af A. Poveda, X.G. del Muro, J.A. López-Guerrero, V. Martínez i inni. GEIS 2013 guidelines for gastrointestinal sarcomas (GIST). „Cancer Chemother Pharmacol”. 74 (5), s. 883–898, 2014. DOI: 10.1007/s00280-014-2547-0. PMID: 25193432.
- ↑ H. Joensuu. Gastrointestinal stromal tumor (GIST). „Ann Oncol”. 17 Suppl 10, 2006. DOI: 10.1093/annonc/mdl274. PMID: 17018739.
- ↑ a b c d e f g h i j k X. Zhao, C. Yue. Gastrointestinal stromal tumor. „J Gastrointest Oncol”. 3 (3), s. 189–208, 2012. DOI: 10.3978/j.issn.2078-6891.2012.031. PMID: 22943011.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa A. Rammohan, J. Sathyanesan, K. Rajendran, A. Pitchaimuthu i inni. A gist of gastrointestinal stromal tumors: A review. „World J Gastrointest Oncol”. 5 (6), s. 102–112, 2013. DOI: 10.4251/wjgo.v5.i6.102. PMID: 23847717.
- ↑ a b c d e f g h i j k l m von Mehren i in. 2016 ↓, s. 77.
- ↑ a b c d e f g h i j k l m von Mehren i in. 2016 ↓, s. 79.
- ↑ a b c d e f g h i j k von Mehren i in. 2016 ↓, s. 80.
- ↑ a b c d e K. Søreide, O.M. Sandvik, J.A. Søreide, V. Giljaca i inni. Global epidemiology of gastrointestinal stromal tumours (GIST): A systematic review of population-based cohort studies. „Cancer Epidemiol”. 40, s. 39–46, 2016. DOI: 10.1016/j.canep.2015.10.031. PMID: 26618334.
- ↑ a b c d e f g h i j k l m n o H. Cichoz-Lach, B. Kasztelan-Szczerbińska, M. Słomka. Gastrointestinal stromal tumors: epidemiology, clinical picture, diagnosis, prognosis and treatment. „Pol Arch Med Wewn”. 118 (4), s. 216–221, Apr 2008. PMID: 18575421. [zarchiwizowane z adresu].
- ↑ a b c d e f g h i j k Goldblum, Weiss i Folpe 2013 ↓, s. 569.
- ↑ a b c d e f g h i j k l m n o p q r s t N. Iorio, R.A. Sawaya, F.K. Friedenberg. Review article: the biology, diagnosis and management of gastrointestinal stromal tumours. „Aliment Pharmacol Ther”. 39 (12), s. 1376–1386, 2014. DOI: 10.1111/apt.12761. PMID: 24749828.
- ↑ a b c d e f g G.D. Demetri, M. von Mehren, C.R. Antonescu, R.P. DeMatteo i inni. NCCN Task Force report: update on the management of patients with gastrointestinal stromal tumors. „J Natl Compr Canc Netw”. 8 (Suppl 2), 2010. DOI: 10.6004/jnccn.2010.0116. PMID: 20457867. PMCID: PMC4103754.
- ↑ A. Agaimy, P.H. Wünsch, F. Hofstaedter, H. Blaszyk i inni. Minute gastric sclerosing stromal tumors (GIST tumorlets) are common in adults and frequently show c-KIT mutations. „Am J Surg Pathol”. 31 (1), s. 113–120, 2007. DOI: 10.1097/01.pas.0000213307.05811.f0. PMID: 17197927.
- ↑ a b c d e f g H. Joensuu. Adjuvant treatment of GIST: patient selection and treatment strategies. „Nat Rev Clin Oncol”. 9 (6), s. 351–318, 2012. DOI: 10.1038/nrclinonc.2012.74. PMID: 22525709.
- ↑ M.A. Sorour, M.I. Kassem, Ael-H. Ghazal, M.T. El-Riwini i inni. Gastrointestinal stromal tumors (GIST) related emergencies. „Int J Surg”. 12 (4), s. 269–280, 2014. DOI: 10.1016/j.ijsu.2014.02.004. PMID: 24530605.
- ↑ a b R.P. DeMatteo, J.J. Lewis, D. Leung, S.S. Mudan i inni. Two hundred gastrointestinal stromal tumors: recurrence patterns and prognostic factors for survival. „Ann Surg”. 231 (1), s. 51–58, 2000. PMID: 10636102.
- ↑ G.A. Escobar, W.A. Robinson, T.L. Nydam, D.C. Heiple i inni. Severe paraneoplastic hypoglycemia in a patient with a gastrointestinal stromal tumor with an exon 9 mutation: a case report. „BMC Cancer”. 7, s. 13, 2007. DOI: 10.1186/1471-2407-7-13. PMID: 17229322.
- ↑ a b c O.S. Din, P.J. Woll. Treatment of gastrointestinal stromal tumor: focus on imatinib mesylate. „Ther Clin Risk Manag”. 4 (1), s. 149–162, 2008. PMID: 18728705.
- ↑ M. Miettinen, L.H. Sobin, J. Lasota. Gastrointestinal stromal tumors of the stomach: a clinicopathologic, immunohistochemical, and molecular genetic study of 1765 cases with long-term follow-up. „Am J Surg Pathol”. 29 (1), s. 52–68, 2005. PMID: 15613856.
- ↑ a b c d Goldblum, Weiss i Folpe 2013 ↓, s. 570.
- ↑ a b c d e f Katarzyna Guzińska-Ustymowicz, Anna Nasierowska-Guttmejer. Nowotwory podścieliskowe przewodu pokarmowego. „Pol J Pathol”, 2013.
- ↑ a b c d e Goldblum, Weiss i Folpe 2013 ↓, s. 571.
- ↑ G. Sommer, V. Agosti, I. Ehlers, F. Rossi i inni. Gastrointestinal stromal tumors in a mouse model by targeted mutation of the Kit receptor tyrosine kinase. „Proc Natl Acad Sci U S A”. 100 (11), s. 6706–6711, 2003. DOI: 10.1073/pnas.1037763100. PMID: 12754375.
- ↑ B.P. Rubin, C.R. Antonescu, J.P. Scott-Browne, M.L. Comstock i inni. A knock-in mouse model of gastrointestinal stromal tumor harboring kit K641E. „Cancer Res”. 65 (15), s. 6631–6639, 2005. DOI: 10.1158/0008-5472.CAN-05-0891. PMID: 16061643.
- ↑ a b c d e f g h i j k l m n o p q C.L. Corless, C.M. Barnett, M.C. Heinrich. Gastrointestinal stromal tumours: origin and molecular oncology. „Nat Rev Cancer”. 11 (12), s. 865–878, Nov 2011. DOI: 10.1038/nrc3143. PMID: 22089421.
- ↑ a b c d J. Lasota, M. Miettinen. KIT and PDGFRA mutations in gastrointestinal stromal tumors (GISTs). „Semin Diagn Pathol”. 23 (2), s. 91–102, 2006. PMID: 17193822.
- ↑ a b c J. Yang, X. Du, A.J. Lazar, R. Pollock i inni. Genetic aberrations of gastrointestinal stromal tumors. „Cancer”. 113 (7), s. 1532–1543, 2008. DOI: 10.1002/cncr.23778. PMID: 18671247.
- ↑ a b A. Maleddu, M.A. Pantaleo, M. Nannini, G. Biasco. The role of mutational analysis of KIT and PDGFRA in gastrointestinal stromal tumors in a clinical setting. „J Transl Med”. 9, s. 75, 2011. DOI: 10.1186/1479-5876-9-75. PMID: 21605429.
- ↑ a b c d Goldblum, Weiss i Folpe 2013 ↓, s. 576.
- ↑ a b Goldblum, Weiss i Folpe 2013 ↓, s. 579.
- ↑ a b c d e f g h i j k Goldblum, Weiss i Folpe 2013 ↓, s. 581.
- ↑ H.J. Kang, S.W. Nam, H. Kim, H. Rhee i inni. Correlation of KIT and platelet-derived growth factor receptor alpha mutations with gene activation and expression profiles in gastrointestinal stromal tumors. „Oncogene”. 24 (6), s. 1066–1074, 2005. DOI: 10.1038/sj.onc.1208358. PMID: 15690055.
- ↑ S. Subramanian, R.B. West, C.L. Corless, W. Ou i inni. Gastrointestinal stromal tumors (GISTs) with KIT and PDGFRA mutations have distinct gene expression profiles. „Oncogene”. 23 (47), s. 7780–7790, 2004. DOI: 10.1038/sj.onc.1208056. PMID: 15326474.
- ↑ a b Goldblum, Weiss i Folpe 2013 ↓, s. 582.
- ↑ a b c Y.M. Wang, M.L. Gu, F. Ji. Succinate dehydrogenase-deficient gastrointestinal stromal tumors. „World J Gastroenterol”. 21 (8), s. 2303–2314, 2015. DOI: 10.3748/wjg.v21.i8.2303. PMID: 25741136.
- ↑ T. Fukasawa, J.M. Chong, S. Sakurai, N. Koshiishi i inni. Allelic loss of 14q and 22q, NF2 mutation, and genetic instability occur independently of c-kit mutation in gastrointestinal stromal tumor. „Jpn J Cancer Res”. 91 (12), s. 1241–1249, 2000. PMID: 11123422.
- ↑ M.C. Heinrich, B.P. Rubin, B.J. Longley, J.A. Fletcher. Biology and genetic aspects of gastrointestinal stromal tumors: KIT activation and cytogenetic alterations. „Hum Pathol”. 33 (5), s. 484–495, 2002. PMID: 12094373.
- ↑ F. Bergmann, B. Gunawan, B. Hermanns, J. Höer i inni. Cytogenetic and morphologic characteristics of gastrointestinal stromal tumors. Recurrent rearrangement of chromosome 1 and losses of chromosomes 14 and 22 as common anomalies. „Verh Dtsch Ges Pathol”. 82, s. 275–278, 1998. PMID: 10095446.
- ↑ a b R. Assämäki, M. Sarlomo-Rikala, J.A. Lopez-Guerrero, J. Lasota i inni. Array comparative genomic hybridization analysis of chromosomal imbalances and their target genes in gastrointestinal stromal tumors. „Genes Chromosomes Cancer”. 46 (6), s. 564–576, 2007. DOI: 10.1002/gcc.20439. PMID: 17330260.
- ↑ a b c d e f g h U.I. Chaudhry, R.P. DeMatteo. Management of resectable gastrointestinal stromal tumor. „Hematol Oncol Clin North Am”. 23 (1), 2009. DOI: 10.1016/j.hoc.2009.01.001. PMID: 19248972.
- ↑ von Mehren i in. 2016 ↓, s. 78.
- ↑ Krzakowski i in. 2015 ↓, s. 896.
- ↑ a b c A. Werewka-Maczuga, T. Osiński, R. Chrzan, M. Buczek i inni. Characteristics of computed tomography imaging of gastrointestinal stromal tumor (GIST) and related diagnostic problems. „Pol J Radiol”. 76 (3), s. 38–48, 2011. PMID: 22802840.
- ↑ a b Y. Zhao, L. Qian, P. Li, S. Zhang. The diagnostic value of endoscopic ultrasonography and contrast-enhanced harmonic endoscopic ultrasonography in gastrointestinal stromal tumors. „Endosc Ultrasound”. 5 (2). s. 111–117. DOI: 10.4103/2303-9027.180475. PMID: 27080610.
- ↑ K. Akahoshi, M. Oya. Gastrointestinal stromal tumor of the stomach: How to manage?. „World J Gastrointest Endosc”. 2 (8), s. 271–277, 2010. DOI: 10.4253/wjge.v2.i8.271. PMID: 21160626.
- ↑ Krzakowski i in. 2015 ↓, s. 895.
- ↑ P.S. Sepe, B. Moparty, M.B. Pitman, J.R. Saltzman i inni. EUS-guided FNA for the diagnosis of GI stromal cell tumors: sensitivity and cytologic yield. „Gastrointest Endosc”. 70 (2), s. 254–261, 2009. DOI: 10.1016/j.gie.2008.11.038. PMID: 19482280.
- ↑ a b Goldblum, Weiss i Folpe 2013 ↓, s. 578.
- ↑ M. Sarlomo-Rikala, A.J. Kovatich, A. Barusevicius, M. Miettinen. CD117: a sensitive marker for gastrointestinal stromal tumors that is more specific than CD34. „Mod Pathol”. 11 (8), s. 728–734, 1998. PMID: 9720500.
- ↑ L.G. Kindblom, H.E. Remotti, F. Aldenborg, J.M. Meis-Kindblom. Gastrointestinal pacemaker cell tumor (GIPACT): gastrointestinal stromal tumors show phenotypic characteristics of the interstitial cells of Cajal. „Am J Pathol”. 152 (5), s. 1259–1269, 1998. PMID: 9588894.
- ↑ M.J. Ríos-Moreno, S. Jaramillo, S. Pereira Gallardo, A. Vallejo i inni. Gastrointestinal stromal tumors (GISTs): CD117, DOG-1 and PKCθ expression. Is there any advantage in using several markers?. „Pathol Res Pract”. 208 (2), s. 74–81, 2012. DOI: 10.1016/j.prp.2011.11.006. PMID: 22197035.
- ↑ I. Espinosa, C.H. Lee, M.K. Kim, B.T. Rouse i inni. A novel monoclonal antibody against DOG1 is a sensitive and specific marker for gastrointestinal stromal tumors. „Am J Surg Pathol”. 32 (2), s. 210–218, 2008. DOI: 10.1097/PAS.0b013e3181238cec. PMID: 18223323.
- ↑ M. Miettinen, Z.F. Wang, J. Lasota. DOG1 antibody in the differential diagnosis of gastrointestinal stromal tumors: a study of 1840 cases. „Am J Surg Pathol”. 33 (9), s. 1401–1408, 2009. DOI: 10.1097/PAS.0b013e3181a90e1a. PMID: 19606013.
- ↑ B. Liegl, J.L. Hornick, C.L. Corless, C.D. Fletcher. Monoclonal antibody DOG1.1 shows higher sensitivity than KIT in the diagnosis of gastrointestinal stromal tumors, including unusual subtypes. „Am J Surg Pathol”. 33 (3), s. 437–446, 2009. DOI: 10.1097/PAS.0b013e318186b158. PMID: 19011564.
- ↑ a b Goldblum, Weiss i Folpe 2013 ↓, s. 577.
- ↑ a b c d Goldblum, Weiss i Folpe 2013 ↓, s. 585.
- ↑ a b Piotr Rutkowski, Jan Kulig, Maciej Krzakowski, Czesław Osuch i inni. Zasady postępowania diagnostyczno-terapeutycznego u chorych na nowotwory podścieliskowe przewodu pokarmowego (GIST). „Nowotwory”, 2011.
- ↑ a b Goldblum, Weiss i Folpe 2013 ↓, s. 586.
- ↑ M. Miettinen, J. Lasota. Histopathology of gastrointestinal stromal tumor. „J Surg Oncol”. 104 (8), s. 865–873, 2011. DOI: 10.1002/jso.21945. PMID: 22069171.
- ↑ a b c von Mehren i in. 2016 ↓, s. 50.
- ↑ a b c Krzakowski i in. 2015 ↓, s. 899.
- ↑ a b c d e von Mehren i in. 2016 ↓, s. 82.
- ↑ a b c d von Mehren i in. 2016 ↓, s. 87.
- ↑ a b c d e f g h i j k l m T. Nishida, J.Y. Blay, S. Hirota, Y. Kitagawa i inni. The standard diagnosis, treatment, and follow-up of gastrointestinal stromal tumors based on guidelines. „Gastric Cancer”. 19 (1), s. 3–14, 2016. DOI: 10.1007/s10120-015-0526-8. PMID: 26276366.
- ↑ a b c d Krzakowski i in. 2015 ↓, s. 901.
- ↑ A.W. Beham, I.M. Schaefer, P. Schüler, S. Cameron i inni. Gastrointestinal stromal tumors. „Int J Colorectal Dis”. 27 (6), s. 689–700, 2012. DOI: 10.1007/s00384-011-1353-y. PMID: 22124674.
- ↑ a b Rutkowski i Nowecki 2009 ↓, s. 188.
- ↑ a b c M. Everett, H. Gutman. Surgical management of gastrointestinal stromal tumors: analysis of outcome with respect to surgical margins and technique. „J Surg Oncol”. 98 (8), s. 588–593, 2008. DOI: 10.1002/jso.21030. PMID: 19072850.
- ↑ a b c d Krzakowski i in. 2015 ↓, s. 898.
- ↑ Rutkowski 2015 ↓, s. 143.
- ↑ a b c d P. Reichardt, H. Joensuu, J.Y. Blay. New fronts in the adjuvant treatment of GIST. „Cancer Chemother Pharmacol”. 72 (4), s. 715–723, 2013. DOI: 10.1007/s00280-013-2248-0. PMID: 23934322.
- ↑ X. Zhi, B. Jiang, J. Yu, O.D. Røe i inni. Prognostic role of microscopically positive margins for primary gastrointestinal stromal tumors: a systematic review and meta-analysis. „Sci Rep”. 6, s. 21541, 2016. DOI: 10.1038/srep21541. PMID: 26891953.
- ↑ A.M. Gouveia, A.P. Pimenta, A.F. Capelinha, D. de la Cruz i inni. Surgical margin status and prognosis of gastrointestinal stromal tumor. „World J Surg”. 32 (11), s. 2375–2382, 2008. DOI: 10.1007/s00268-008-9704-8. PMID: 18685890.
- ↑ M.D. McCarter, C.R. Antonescu, K.V. Ballman, R.G. Maki i inni. Microscopically positive margins for primary gastrointestinal stromal tumors: analysis of risk factors and tumor recurrence. „J Am Coll Surg”. 215 (1), s. 53–59; discussion 59–60, 2012. DOI: 10.1016/j.jamcollsurg.2012.05.008. PMID: 22726733.
- ↑ K. Chen, Y.C. Zhou, Y.P. Mou, X.W. Xu i inni. Systematic review and meta-analysis of safety and efficacy of laparoscopic resection for gastrointestinal stromal tumors of the stomach. „Surg Endosc”. 29 (2), s. 355–367, 2015. DOI: 10.1007/s00464-014-3676-6. PMID: 25005014.
- ↑ von Mehren i in. 2016 ↓, s. 17.
- ↑ a b c d e f A. Jakhetiya, P.K. Garg, G. Prakash, J. Sharma i inni. Targeted therapy of gastrointestinal stromal tumours. „World J Gastrointest Surg”. 8 (5), s. 345–352, 2016. DOI: 10.4240/wjgs.v8.i5.345. PMID: 27231512.
- ↑ B.K. Bednarski, D.M. Araujo, M. Yi, K.E. Torres i inni. Analysis of prognostic factors impacting oncologic outcomes after neoadjuvant tyrosine kinase inhibitor therapy for gastrointestinal stromal tumors. „Ann Surg Oncol”. 21 (8), s. 2499–2505, 2014. DOI: 10.1245/s10434-014-3632-7. PMID: 24639192.
- ↑ a b c von Mehren i in. 2016 ↓, s. 81.
- ↑ M. Fiore, E. Palassini, E. Fumagalli, S. Pilotti i inni. Preoperative imatinib mesylate for unresectable or locally advanced primary gastrointestinal stromal tumors (GIST). „Eur J Surg Oncol”. 35 (7), s. 739–745, 2009. DOI: 10.1016/j.ejso.2008.11.005. PMID: 19110398.
- ↑ J.C. McAuliffe, K.K. Hunt, A.J. Lazar, H. Choi i inni. A randomized, phase II study of preoperative plus postoperative imatinib in GIST: evidence of rapid radiographic response and temporal induction of tumor cell apoptosis. „Ann Surg Oncol”. 16 (4), s. 910–919, 2009. DOI: 10.1245/s10434-008-0177-7. PMID: 18953611.
- ↑ A. Blesius, P.A. Cassier, F. Bertucci, J. Fayette i inni. Neoadjuvant imatinib in patients with locally advanced non metastatic GIST in the prospective BFR14 trial. „BMC Cancer”. 11, s. 72, 2011. DOI: 10.1186/1471-2407-11-72. PMID: 21324142.
- ↑ B.L. Eisenberg, I. Judson. Surgery and imatinib in the management of GIST: emerging approaches to adjuvant and neoadjuvant therapy. „Ann Surg Oncol”. 11 (5), s. 465–475, 2004. DOI: 10.1245/ASO.2004.09.011. PMID: 15123459.
- ↑ a b c d e f g von Mehren i in. 2016 ↓, s. 88.
- ↑ C.L. Corless, K.V. Ballman, C.R. Antonescu, V. Kolesnikova i inni. Pathologic and molecular features correlate with long-term outcome after adjuvant therapy of resected primary GI stromal tumor: the ACOSOG Z9001 trial. „J Clin Oncol”. 32 (15), s. 1563–1570, 2014. DOI: 10.1200/JCO.2013.51.2046. PMID: 24638003.
- ↑ R.P. Dematteo, K.V. Ballman, C.R. Antonescu, R.G. Maki i inni. Adjuvant imatinib mesylate after resection of localised, primary gastrointestinal stromal tumour: a randomised, double-blind, placebo-controlled trial. „Lancet”. 373 (9669), s. 1097–1104, 2009. DOI: 10.1016/S0140-6736(09)60500-6. PMID: 19303137.
- ↑ H. Joensuu, M. Eriksson, K. Sundby Hall, J.T. Hartmann i inni. One vs three years of adjuvant imatinib for operable gastrointestinal stromal tumor: a randomized trial. „JAMA”. 307 (12), s. 1265–1272, 2012. DOI: 10.1001/jama.2012.347. PMID: 22453568.
- ↑ T. Nishida, T. Doi, Y. Naito. Tyrosine kinase inhibitors in the treatment of unresectable or metastatic gastrointestinal stromal tumors. „Expert Opin Pharmacother”. 15 (14), s. 1979–1789, 2014. DOI: 10.1517/14656566.2014.937707. PMID: 24990162.
- ↑ G.D. Demetri, M. von Mehren, C.D. Blanke, . AD. Van den Abbeele i inni. Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. „N Engl J Med”. 347 (7), s. 472–480, 2002. DOI: 10.1056/NEJMoa020461. PMID: 12181401.
- ↑ C.D. Blanke, G.D. Demetri, M. von Mehren, M.C. Heinrich i inni. Long-term results from a randomized phase II trial of standard- versus higher-dose imatinib mesylate for patients with unresectable or metastatic gastrointestinal stromal tumors expressing KIT. „J Clin Oncol”. 26 (4), s. 620–625, 2008. DOI: 10.1200/JCO.2007.13.4403. PMID: 18235121.
- ↑ M. von Mehren i inni, Follow-up results after 9 years (yrs) of the ongoing, phase II B2222 trial of imatinib mesylate (IM) in patients (pts) with metastatic or unresectable KIT+ gastrointestinal stromal tumors (GIST), „Journal of Clinical Oncology”, 29 (15_suppl), 2011, DOI: 10.1200/jco.2011.29.15_suppl.10016, PMID: 28021121 [zarchiwizowane z adresu 2017-02-25].
- ↑ J. Verweij, P.G. Casali, J. Zalcberg, A. LeCesne i inni. Progression-free survival in gastrointestinal stromal tumours with high-dose imatinib: randomised trial. „Lancet”. 364. s. 1127–1134. DOI: 10.1016/S0140-6736(04)17098-0. PMID: 15451219.
- ↑ a b c J.R. Zalcberg, J. Verweij, P.G. Casali, A. Le Cesne i inni. Outcome of patients with advanced gastro-intestinal stromal tumours crossing over to a daily imatinib dose of 800 mg after progression on 400 mg. „Eur J Cancer”. 41 (12), s. 1751–1757, 2005. DOI: 10.1016/j.ejca.2005.04.034. PMID: 16098458.
- ↑ a b C.D. Blanke, C. Rankin, G.D. Demetri, C.W. Ryan i inni. Phase III randomized, intergroup trial assessing imatinib mesylate at two dose levels in patients with unresectable or metastatic gastrointestinal stromal tumors expressing the kit receptor tyrosine kinase: S0033. „J Clin Oncol”. 26 (4), s. 626–632, 2008. DOI: 10.1200/JCO.2007.13.4452. PMID: 18235122.
- ↑ von Mehren i in. 2016 ↓, s. 80–81.
- ↑ a b Comparison of two doses of imatinib for the treatment of unresectable or metastatic gastrointestinal stromal tumors: a meta-analysis of 1,640 patients. „J Clin Oncol”. 28 (7), s. 1247–1253, 2010. DOI: 10.1200/JCO.2009.24.2099. PMID: 20124181.
- ↑ a b M. Debiec-Rychter, R. Sciot, A. Le Cesne, M. Schlemmer i inni. KIT mutations and dose selection for imatinib in patients with advanced gastrointestinal stromal tumours. „Eur J Cancer”. 42 (8), s. 1093–1103, 2006. DOI: 10.1016/j.ejca.2006.01.030. PMID: 16624552.
- ↑ M.C. Heinrich, C.L. Corless, G.D. Demetri, C.D. Blanke i inni. Kinase mutations and imatinib response in patients with metastatic gastrointestinal stromal tumor. „J Clin Oncol”. 21 (23), s. 4342–4349, 2003. DOI: 10.1200/JCO.2003.04.190. PMID: 14645423.
- ↑ M. Debiec-Rychter, H. Dumez, I. Judson, B. Wasag i inni. Use of c-KIT/PDGFRA mutational analysis to predict the clinical response to imatinib in patients with advanced gastrointestinal stromal tumours entered on phase I and II studies of the EORTC Soft Tissue and Bone Sarcoma Group. „Eur J Cancer”. 40 (5), s. 689–695, 2004. DOI: 10.1016/j.ejca.2003.11.025. PMID: 15010069.
- ↑ C.L. Corless, A. Schroeder, D. Griffith, A. Town i inni. PDGFRA mutations in gastrointestinal stromal tumors: frequency, spectrum and in vitro sensitivity to imatinib. „J Clin Oncol”. 23 (23), s. 5357–5364, 2005. DOI: 10.1200/JCO.2005.14.068. PMID: 15928335.
- ↑ von Mehren i in. 2016 ↓, s. 23.
- ↑ a b c d von Mehren i in. 2016 ↓, s. 83.
- ↑ G.D. Demetri, A.T. van Oosterom, C.R. Garrett, M.E. Blackstein i inni. Efficacy and safety of sunitinib in patients with advanced gastrointestinal stromal tumour after failure of imatinib: a randomised controlled trial. „Lancet”. 368 (9544), s. 1329–1338, 2006. DOI: 10.1016/S0140-6736(06)69446-4. PMID: 17046465.
- ↑ P. Reichardt, Y.K. Kang, P. Rutkowski, J. Schuette i inni. Clinical outcomes of patients with advanced gastrointestinal stromal tumors: safety and efficacy in a worldwide treatment-use trial of sunitinib. „Cancer”. 121 (9), s. 1405–1413, 2015. DOI: 10.1002/cncr.29220. PMID: 25641662.
- ↑ S. George, J.Y. Blay, P.G. Casali, A. Le Cesne i inni. Clinical evaluation of continuous daily dosing of sunitinib malate in patients with advanced gastrointestinal stromal tumour after imatinib failure. „Eur J Cancer”. 45 (11), s. 1959–1968, 2009. DOI: 10.1016/j.ejca.2009.02.011. PMID: 19282169.
- ↑ M.C. Heinrich, R.G. Maki, C.L. Corless, C.R. Antonescu i inni. Primary and secondary kinase genotypes correlate with the biological and clinical activity of sunitinib in imatinib-resistant gastrointestinal stromal tumor. „J Clin Oncol”. 26 (33), s. 5352–5359, 2008. DOI: 10.1200/JCO.2007.15.7461. PMID: 18955458.
- ↑ a b c d von Mehren i in. 2016 ↓, s. 89.
- ↑ G.D. Demetri, P. Reichardt, Y.K. Kang, J.Y. Blay i inni. Efficacy and safety of regorafenib for advanced gastrointestinal stromal tumours after failure of imatinib and sunitinib (GRID): an international, multicentre, randomised, placebo-controlled, phase 3 trial. „Lancet”. 381 (9863), s. 295–302, 2013. DOI: 10.1016/S0140-6736(12)61857-1. PMID: 23177515.
- ↑ Y.K. Kang, M.H. Ryu, C. Yoo, B.Y. Ryoo i inni. Resumption of imatinib to control metastatic or unresectable gastrointestinal stromal tumours after failure of imatinib and sunitinib (RIGHT): a randomised, placebo-controlled, phase 3 trial. „Lancet Oncol”. 14 (12), s. 1175–1182, 2013. DOI: 10.1016/S1470-2045(13)70453-4. PMID: 24140183.
- ↑ P. Reichardt, J.Y. Blay, H. Gelderblom, M. Schlemmer i inni. Phase III study of nilotinib versus best supportive care with or without a TKI in patients with gastrointestinal stromal tumors resistant to or intolerant of imatinib and sunitinib. „Ann Oncol”. 23 (7), s. 1680–1687, 2012. DOI: 10.1093/annonc/mdr598. PMID: 22357255.
- ↑ U. Kefeli, M. Benekli, A. Sevinc, R. Yildiz i inni. Efficacy of sorafenib in patients with gastrointestinal stromal tumors in the third- or fourth-line treatment: A retrospective multicenter experience. „Oncol Lett”. 6 (2), s. 605–611, 2013. DOI: 10.3892/ol.2013.1408. PMID: 24137379.
- ↑ S.H. Park, M.H. Ryu, B.Y. Ryoo, S.A. Im i inni. Sorafenib in patients with metastatic gastrointestinal stromal tumors who failed two or more prior tyrosine kinase inhibitors: a phase II study of Korean gastrointestinal stromal tumors study group. „Invest New Drugs”. 30 (6), s. 2377–2383, 2012. DOI: 10.1007/s10637-012-9795-9. PMID: 22270258.
- ↑ J. Maurel, A.S. Martins, A. Poveda, J.A. López-Guerrero i inni. Imatinib plus low-dose doxorubicin in patients with advanced gastrointestinal stromal tumors refractory to high-dose imatinib: a phase I-II study by the Spanish Group for Research on Sarcomas. „Cancer”. 116 (15), s. 3692–3701, 2010. DOI: 10.1002/cncr.25111. PMID: 20564079.
- ↑ a b c Z.M. Bamboat, R.P. DeMatteo. Metastasectomy for gastrointestinal stromal tumors. „J Surg Oncol”. 109 (1), s. 23–27, 2014. DOI: 10.1002/jso.23451. PMID: 24155153.
- ↑ Krzakowski i in. 2015 ↓, s. 903.
- ↑ S.J. Sym, M.H. Ryu, J.L. Lee, H.M. Chang i inni. Surgical intervention following imatinib treatment in patients with advanced gastrointestinal stromal tumors (GISTs). „J Surg Oncol”. 98 (1), s. 27–33, 2008. DOI: 10.1002/jso.21065. PMID: 18452195.
- ↑ C.P. Raut, Q. Wang, J. Manola, J.A. Morgan i inni. Cytoreductive surgery in patients with metastatic gastrointestinal stromal tumor treated with sunitinib malate. „Ann Surg Oncol”. 17 (2), s. 407–415, 2010. DOI: 10.1245/s10434-009-0784-y. PMID: 19898902.
- ↑ C.P. Raut, M. Posner, J. Desai, J.A. Morgan i inni. Surgical management of advanced gastrointestinal stromal tumors after treatment with targeted systemic therapy using kinase inhibitors. „J Clin Oncol”. 24 (15), s. 2325–2331, 2006. DOI: 10.1200/JCO.2005.05.3439. PMID: 16710031.
- ↑ R.P. Dematteo, M.C. Heinrich, W.M. El-Rifai, G. Demetri. Clinical management of gastrointestinal stromal tumors: before and after STI-571. „Hum Pathol”. 33 (5), s. 466–477, 2002. PMID: 12094371.
- ↑ H. Choi, C. Charnsangavej, S.C. Faria, H.A. Macapinlac i inni. Correlation of computed tomography and positron emission tomography in patients with metastatic gastrointestinal stromal tumor treated at a single institution with imatinib mesylate: proposal of new computed tomography response criteria. „J Clin Oncol”. 25 (13), s. 1753–1759, 2007. DOI: 10.1200/JCO.2006.07.3049. PMID: 17470865.
- ↑ U. Güller, I. Tarantino, T. Cerny, B.M. Schmied i inni. Population-based SEER trend analysis of overall and cancer-specific survival in 5138 patients with gastrointestinal stromal tumor. „BMC Cancer”. 15, s. 557, 2015. DOI: 10.1186/s12885-015-1554-9. PMID: 26223313.
- ↑ M.T. Mazur, H.B. Clark. Gastric stromal tumors. Reappraisal of histogenesis. „Am J Surg Pathol”. 7 (6), s. 507–519, 1983. PMID: 6625048.
- ↑ J.D. Huizinga, L. Thuneberg, M. Klüppel, J. Malysz i inni. W/kit gene required for interstitial cells of Cajal and for intestinal pacemaker activity. „Nature”. 373 (6512), s. 347–349, 1995. DOI: 10.1038/373347a0. PMID: 7530333.
- ↑ S. Hirota, K. Isozaki, Y. Moriyama, K. Hashimoto i inni. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. „Science”. 279 (5350), s. 577–580, 1998. PMID: 9438854.
- ↑ H. Joensuu, P.J. Roberts, M. Sarlomo-Rikala, L.C. Andersson i inni. Effect of the tyrosine kinase inhibitor STI571 in a patient with a metastatic gastrointestinal stromal tumor. „N Engl J Med”. 344 (14), s. 1052–1056, 2001. DOI: 10.1056/NEJM200104053441404. PMID: 11287975.
- ↑ a b V. Gillespie, K. Baer, J. Farrelly, D. Craft i inni. Canine gastrointestinal stromal tumors: immunohistochemical expression of CD34 and examination of prognostic indicators including proliferation markers Ki67 and AgNOR. „Vet Pathol”. 48 (1), s. 283–291, Jan 2011. DOI: 10.1177/0300985810380397. PMID: 20826846.
- ↑ a b Robert Klopfleisch: Veterinary Oncology: A Short Textbook. Springer, 2016, s. 185. ISBN 978-3-319-41124-8.
- ↑ a b c d Stephen J. Ettinger, Edward C. Feldman: Textbook of Veterinary Internal Medicine – eBook. Elsevier Health Sciences, 2009, s. 1569–1570. ISBN 978-1-4377-0282-8.
- ↑ K.N. Russell, S.J. Mehler, K.A. Skorupski, J.L. Baez i inni. Clinical and immunohistochemical differentiation of gastrointestinal stromal tumors from leiomyosarcomas in dogs: 42 cases (1990–2003). „J Am Vet Med Assoc”. 230 (9), s. 1329–1333, 2007. DOI: 10.2460/javma.230.9.1329. PMID: 17472558.
- ↑ M. Irie, Y. Takeuchi, Y. Ohtake, H. Suzuki i inni. Imatinib mesylate treatment in a dog with gastrointestinal stromal tumors with a c-kit mutation. „J Vet Med Sci”. 77 (11), s. 1535–1539, 2015. DOI: 10.1292/jvms.15-0096. PMID: 26074249.
- ↑ M. Takanosu, S. Amano, Y. Kagawa. Analysis of c-KIT exon 11 mutations in canine gastrointestinal stromal tumours. „Vet J”. 207, s. 118–123, 2016. DOI: 10.1016/j.tvjl.2015.10.051. PMID: 26631948.
Bibliografia
[edytuj | edytuj kod]- John R. Goldblum, Sharon W. Weiss, Andrew L. Folpe: Enzinger and Weiss’s Soft Tissue Tumors. Wyd. 6. Elsevier Health Sciences, 2013. ISBN 978-0-323-08834-3.
- Margaret von Mehren, R. Lor Randall, Robert S. Benjamin, Sarah Boles i inni. Soft Tissue Sarcoma Version 1.2016. „J Natl Compr Canc Netw”, 2016.
- Maciej Krzakowski, Piotr Potemski, Krzysztof Warzocha, Pior Wysocki: Onkologia kliniczna. T. II. Via Medica, 2015. ISBN 978-83-7599-796-5.
- Murray F. Brennan, Cristina R. Antonescu, Robert G. Maki: Management of Soft Tissue Sarcoma. Springer Science & Business Media, 2012.
- Jerzy Stachura, Wenancjusz Domagała: Patologia znaczy słowo o chorobie. T. II. Polska Akademia Umiejętności, 2009. ISBN 978-83-60184-02-8.
- Piotr Rutkowski: Biblioteka chirurga onkologa. Mięsaki tkanek miękkich. Via Medica, 2015. ISBN 978-83-7599-864-1.
- Piotr Rutkowski, Zbigniew Nowecki: Mięsaki tkanek miękkich u dorosłych. Medical Tribune, 2009. ISBN 978-83-60135-69-3.
